|
略歴
1992年 東京水産大学水産学部卒業
1997年 新潟大学大学院自然科学研究科博士後期課程修了 博士(理学)
1998年 日本学術振興会未来開拓学術研究推進事業研究員
1999年 日本学術振興会特別研究員
2002年 科学技術振興事業団さきがけ研究21「認識と形成」領域専任研究員
2007年 宇都宮大学遺伝子実験施設准教授 現在に至る。
●はじめに
哺乳類の性は性染色体の組み合わせによって決められている。すなわち、X染色体をもつ精子が授精するか、Y染色体をもつ精子が授精するかによって、その個体の性は決まるのである。将来、精巣もしくは卵巣に分化する生殖巣は、発生初期は未分化で双方に分化する能力をもっている。授精の瞬間に決まった性に従って、未分化生殖巣は精巣、もしくは卵巣へと分化し、生殖巣の性に従って個体の性は決定される。脊椎動物の性は、哺乳類のように遺伝的に決められる種が多数であると思われるが、爬虫類や魚類の一部には環境要因により決められる種もある。また、魚類には一生の間に精巣をもつ雄の時期と卵巣をもつ雌の時期とを行き来する種や、精巣と卵巣とを同時にもつ雌雄同体の種も報告されている。このように魚類の性決定・性分化の様子は哺乳類のそれと比べると非常に多様である。また、上記のように自然に起こる性転換に加え、遺伝的に性の決められている多くの種でも性ステロイドホルモン処理により、性を人為的に転換させることが可能である。通常、これら性転換個体は正常な精子や卵をつくる。このように哺乳類と比べて性の可塑性が大きいことが、魚類を性決定・性分化のモデル動物として使用する利点の一つである。
遺伝的に性が決定される種には性決定遺伝子が存在するはずである。哺乳類の性決定遺伝子(SRY/Sry)の同定(1990年)以来、多くの研究者が他の脊椎動物種において性決定遺伝子の同定を試みた。しかしながら、現在のところ、性決定遺伝子として同定されているのは、大多数の有胎盤哺乳類に共通なSRY/Sry遺伝子と最近我々が同定したメダカのDMY遺伝子1)のみである。哺乳類の場合、X染色体とY染色体とは形態が大きく異なっている。また、Y染色体特異的な遺伝子が多数存在する。つまり、哺乳類のX染色体とY染色体とは形態的にも機能的にも大きく異なっている。一方、魚類では性染色体の形態が異なる種もあるが、大多数の種において、性染色体は形態的に分化していない。メダカの場合、性決定様式はXX-XY型の雄へテロであるが、性転換処理により得たXX雄は正常な精子を、XYやYYの雌も正常な卵を産む。つまり、哺乳類の場合と異なり、XX個体も精巣形成、精子形成に必要な遺伝子をすべてもっているし、YY個体も卵巣形成、卵形成に必要な遺伝子を全て持っているのである。このことから、メダカを含めて多くの魚類では、X染色体とY染色体(もしくはZ染色体とW染色体)との間には機能的(存在している遺伝子)に大差はないと考えられ、性分化の引き金を引く遺伝子のみが異なると考えられる。
●なぜメダカで性決定遺伝子が同定できたか
哺乳類以外の脊椎動物における性決定遺伝子同定の試みは、ほとんどが失敗に終わった。このような状況下、我々がメダカ性決定遺伝子同定に成功した理由は、メダカが本来もっていた実験動物としての特性を活かしたことにある。
1. 性が遺伝的に決まること
魚類の性決定様式はざまざまである。メダカのように性が遺伝的に決定されている種から、環境要因により性が決定されている種まである。発生生物学のモデル生物として多用されているゼブラフィッシュでは、ゲノムの全塩基配列が明らかとなりつつあるが、性決定様式さえ不明である。
メダカの性が遺伝的に決められていることは、會田龍雄 (1921) が体色の黄色(緋色)を決める遺伝子の限性遺伝を発見したことにより明らかとなった。d-rR系統ではr遺伝子座の劣性対立遺伝子rがX染色体上に、優性対立遺伝子RがY染色体上に存在する結果、XX個体(遺伝子型rr)は体色が白色で雌、XY個体(遺伝子型Rr)は体色が黄色で雄となる。したがって、この系統では、遺伝的な性を体色で判定できる。この系統を用いた性転換の研究は1950-60年代に山本時男により多数報告され、性分化研究の基盤をつくった。
2. 近交系の存在
近交系は、兄妹交配を20世代以上繰り返すことにより得られる遺伝的に均一な系統である。放射線感受性など個体間のばらつきの大きい遺伝形質が均一になることに加えて、ゲノムの塩基配列を調べた時に多型を考慮しなくてよいことも遺伝学的研究には有効である。ゲノムシークエンス計画も近交系の一つであるHd-rR系統を用いてなされた2)。このような近交系が利用できる脊椎動物は哺乳類以外ではメダカだけである。
3. 大きな種内変異
日本産の野生メダカは、北日本集団、南日本集団という2つの地域集団に分けられる。この両集団は遺伝的に大きく異なっている。ミトコンドリアゲノムの塩基配列で8.9%3)、核ゲノムで3.4%2)の違いがある。さらに、それぞれの集団から近交系が樹立しており、これらの近交系の間では自由に交配ができる。詳細な遺伝地図を構築するために必須のDNAマーカーを得るには、系統間の多型が必要である。メダカの場合、北日本集団由来の近交系と南日本集団由来の近交系の間では、ゲノム100塩基を比較すれば、3個程度の塩基置換(多型)が検出できるという計算になり、容易にDNAマーカーが得られる。
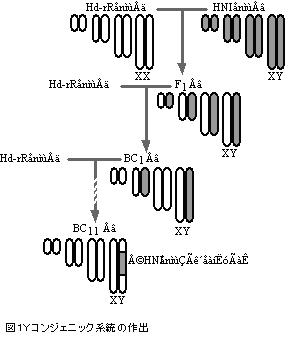
4. Yコンジェニックメダカ
これまでに述べたメダカの特徴を性決定遺伝子同定のために最大限に活用するのを可能にしたのが、Yコンジェニックメダカ系統の作出であった。Yコンジェニック系統は、南日本集団由来の近交系Hd-rRの雌と北日本集団由来の近交系HNIの雄とを交配して得たF1雄をHd-rR雌へ戻し交配することを繰り返すことにより、Hd-rRの遺伝的背景に、HNIの性決定領域(Y染色体の一部)を導入したものである(図1)。この系統は、d-rR系統と同様に遺伝的な性を体色から判定できる。また、HNI由来のゲノムはY染色体上の性決定領域周辺のみに存在する。つまり、この系統の雄のゲノムでは、性決定領域周辺のみがHd-rRとHNIのヘテロ接合の状態になっている。したがって、DNAマーカーの遺伝子型がヘテロであれば、このマーカーは性連鎖であると言える4)。
●メダカ性決定遺伝子の同定
すでにメダカ性決定遺伝子同定に関する総説が5,6)あるので、ここでは簡単に述べる。
1. ポジショナルクローニングのための準備 (その1)
メダカの性決定遺伝子は性染色体上に存在するが、具体的な機能や相同遺伝子の存否は不明であった。このように正体不明な遺伝子を同定するには、染色体上の位置情報をもとに遺伝子を同定する「ポジショナルクローニング法」が最適である。
これは、表現型から遺伝子をクローニングする方法で順遺伝学の王道であるが、当時メダカではまだ成功例がなかった。それは大きなインサートを含むゲノムライブラリーが存在しなかったからである。そこでまず、大きなインサートを保持できる細菌人工染色体(BAC)ベクターを用いたゲノムライブラリーを慶応大学の浅川修一助手、清水信義教授、名古屋大学の堀寛教授らの協力を得て作成した1, 7)。BACライブラリーと性連鎖DNAマーカーがあれば、染色体歩行を繰り返すことで、遺伝地図を物理地図と対応づけていける。
BACライブラリー構築に我々が用いたゲノムDNAのソースに“ミソ”がある。それは、上述のYコンジェニック系統の雄を用いたことである。この系統の雄は、X染色体がHd-rR由来、 Y染色体がHNI由来のため、X染色体とY染色体を区別しながら染色体歩行(後述)をすることができるからである。
2. ポジショナルクローニングのための準備 (その2)
もう一つ、性決定遺伝子のポジショナルクローニングに必要な道具は、性決定領域周辺での組換個体である。性決定遺伝子近傍での組換個体が多ければ多いほど、性決定遺伝子を詳細にマップできる。しかし、XY雄ではY染色体の性決定領域を含む大きな領域でX染色体との間で組換が起こらなかった。一方、性転換したXY雌では、ある程度組換が起こることが分かっていた8)。そこで、Yコンジェニック系統から性転換XY雌を得、その子孫数万尾から組換個体を探索した。
3. 染色体歩行
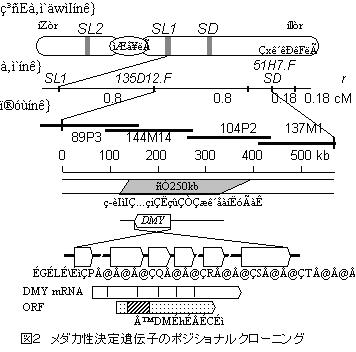
蛍光in situハイブリダイゼーション法による性染色体の同定4)と、動原体地図9)から、メダカの性染色体は染色体の中で一番大きい次中部動原体型染色体の一つで、性決定領域は、その長腕に存在することが分かっていた。性決定領域と約1センチモルガン(cM、100個体に1個体の組換個体が得られる)の遺伝距離にマップされていたDNAマーカーであるSL110)は長腕の性決定領域より動原体側に位置していた。また、テロメア側には体色のr遺伝子座がマップされていた。そこで、SL1より染色体歩行を開始した。手順の概略は以下のようである(図2)。
まず、SL1をプローブにBACライブラリーをスクリーニングし、SL1を含むBACクローンを得る。このBACクローンの末端配列より新たなDNAマーカーを作ることができる。このDNAマーカーをプローブとして再びBACライブラリーをスクリーニングするとともに、組換個体の遺伝子型を調べることで、性決定領域の詳細な遺伝地図を作成できる。SL1から8回目の染色体歩行の結果得たDNAマーカー 51H7.F が、性決定遺伝子を挟んでSL1の反対側に達したことで、性決定遺伝子を含む領域をカバーするBACコンティグが完成した。この時点で、メダカY染色体の性決定領域は4つのBACクローンでカバーされた。つまり、この4つのBACクローンの中に性決定遺伝子は存在するはずである。
4. Y染色体の性決定領域を欠失したXY雌個体の発見
次の作業は、この領域から性決定遺伝子の候補遺伝子を探すことである。cDNAセレクション、エクソントラップなどの方法も考えられたが、最も結果が早く出ると予想した「性決定領域の全塩基配列決定」を行うことにした。4つのBACクローンの塩基配列をショットガンシークエンス法により決定した結果、この領域が約530kbであることが分かった。全塩基配列決定直前(ドラフトシークエンスは得ていた時)に、自然発生の性転換XY雌と思われるメダカをYコンジェニック系統の中に発見した。この個体のY染色体を詳細に調べたところ、4つのBACクローンにカバーされた性決定領域のうち半分ほどの領域(約250kb)が欠失していることが判明した。つまり、このXY個体は、250kbの領域を欠いたために雄に分化できずに雌になったと考えられた。よって、この250kbの領域に性決定領域は絞り込まれた。後に明らかとなったことだが、この欠損した領域こそが、Y染色体特異的な領域であった。
5. 遺伝子の予測
ショットガンシークエンスから得られた塩基配列データをもとに遺伝子予測プログラムで探索したところ、この領域に27遺伝子が予測されたので、そのすべてについて、RT-PCR法により発現を調べた結果、1つの遺伝子が、性分化時である孵化時に雄特異的に発現していた。RACE法によりこの遺伝子の全長をクローニングし、アミノ酸配列を推定したところ、「DMドメイン」と呼ばれる特徴的なアミノ酸配列類似の領域が含まれていた。DMドメインはショウジョウバエの性分化に関わるdouble sex (dsx) 遺伝子と線虫の性分化に関わるmale abnormal-3 (mab-3) 遺伝子に共通に見いだされたアミノ酸配列である。そこで、この遺伝子に「Y染色体のDMドメイン遺伝子」ということでDMYと名前をつけた1)。(ほぼ同時期にメダカでDMドメイン遺伝子の相同遺伝子を探索していたドイツのManfred Schartl博士のグループもこの遺伝子にたどり着いてdmrt1bYと名前を付けている。)
6. 性決定遺伝子であることの証明
性決定領域から発見されたDMYはメダカ性決定遺伝子の最有力候補である。この遺伝子が性決定遺伝子であるということを示すためには、Loss-of- functionの実験とGain-of-functionの実験が必要である。前者は DMYは存在するのに、 その機能欠損で雄にならないこと、後者はDMYのない遺伝的雌 (XX) 個体にDMYを導入して雄になることを示せばよいわけである。
メダカの場合、エストロゲン処理により誘導されたXY雌は、正常雌となんら変わりなく成熟し、受精可能な卵を産むことから、DMY遺伝子が機能しない場合、その個体は雌に分化するだけでその個体の生死や生殖能力には影響しないと考えられる。それならば、野生集団においてランダムに生じた突然変異中に、性決定遺伝子の突然変異は比較的高頻度に残っているのではないかと予想し、野生メダカからDMY遺伝子の突然変異体を探索することにした。具体的には、野生メダカの表現型の性別とDMYの有無との関係を調べた。その結果、新潟県旧白根市と福井県旧芦原町よりDMYを持つ雌を発見した。交配実験により詳しく調べてみると、白根のメダカではDMYの発現量が減少しており、このY染色体を受け継いだ子孫の約3分の2が雌に分化した。一方、芦原のメダカでは第3エキソンに1塩基の挿入があり、そのために不完全なDMYタンパクができていると予想された。このY染色体を受け継いだ個体は、全て雌だった11)。
Gain-of-function の実験では、DMY遺伝子を含むBACクローンをd-rR系統の1細胞期にマイクロインジェクションすることで、トランスジェニックメダカを作出した。親になったXX(白色)個体58個体のうち13個体の二次性徴は雄型であった。また、そのうち8個体からは、次世代を得ることができた12)。
以上から、DMYはメダカの性決定遺伝子としての必要十分条件を満たすことが明らかになり、「DMYはメダカの性決定遺伝子である」という結論に達することができた。
●DMYの多様性
1. DMYの起源
DMYがメダカの性決定遺伝子であるとすると、次の興味は、DMYはいつどの系統で生じたのかという起源の問題である。
メダカに最も近縁なハイナンメダカを手始めにDMYを探した。メダカ用のPCRプライマーセットでハイナンメダカのゲノムからDMYの増幅に成功し、RT-PCRやRACE法によりcDNA全長の塩基配列決定にも成功した。ハイナンメダカのDMYは雄ゲノムのみに存在し、当然その発現も雄でのみ検出された。また、メダカでDMYに連鎖したDNAマーカーは、ハイナンメダカでもDMYに連鎖していたことから、ハイナンメダカのY染色体はメダカのY染色体と相同であると考えられた。DMYに配列が最も似ている遺伝子であるDMRT1のアミノ酸配列とDMYのそれとを比べて作成した分子系統樹は、メダカとハイナンメダカの共通祖先でDMYがDMRT1から分岐したことを示した13)。つまり、DMYの起源は新しく、メダカにごく近縁の種にのみDMYが存在するということである。
2. 他のメダカ属魚類の性決定遺伝子
その後、メダカ属魚類のひとつであるインドメダカ(O. dancena)の性決定について新しい知見が報告されている14)。DMYをもたないインドメダカの性はXX-XY型の性決定様式により決まるものの、性決定遺伝子の存在する染色体はメダカの性染色体 (1番染色体) ではなく常染色体 (10番染色体) と相同であることが判明した。つまり、メダカとは全く別の性決定遺伝子がインドメダカでは性決定遺伝子として働いていると推測される。
さらに、インドメダカと近縁であるハブスメダカ(O. hubbsi)の性決定様式がZZ-ZW型であることが明らかになった15)。しかも、その性染色体はメダカの常染色体である5番染色体と相同であった。この種ではZ染色体とW染色体の間に逆位が存在し、性染色体の形態も分化していた。これら2種の性決定遺伝子が明らかになれば、XX-XY型とZZ-ZW型間の性決定様式の変更のメカニズムが明らかになることが期待される。
未発表の種も含めて考えると、メダカの近縁種においては、(ハイナンメダカを除いて)種毎に様々な性染色体が進化しているようである。どのぐらい多様な遺伝子がメダカ類の性決定に関わっているのか、今後どんな新しい性決定遺伝子が見つかってくるのか、哺乳類の性決定カスケードとの接点は何か、興味は尽きない。
DMYと性分化
1. メダカ生殖巣の性分化
個体の性を決める生殖巣は生殖細胞と体細胞とから構成される。生殖細胞のもととなる始原生殖細胞は、生殖巣形成域から離れたところで分化し、生殖巣形成部位へと移動する。発生過程において、メダカ生殖巣の形態的な雌雄差は孵化前の生殖細胞数に現れる。すなわち、孵化前のXX個体では生殖細胞の分裂活性が高まり生殖細胞数が増加するのに対して、XY個体ではさほど分裂しないために、孵化の時点でXX個体はXY個体の2〜3倍の生殖細胞をもつ。また、XX個体では孵化後、減数分裂に移行している生殖細胞を観察できる16)。
2. DMYの発現
in situハイブリダイゼーション法によると移動中の始原生殖細胞周辺の体細胞、生殖巣形成部位の体細胞では共にDMYの発現は検出されない。一方、生殖巣形成部位に到達した生殖細胞を取り囲む体細胞(将来のセルトリ細胞)では、DMYの発現が検出される16)。このことから、性決定遺伝子の発現は、哺乳類のSryと同様にセルトリ細胞系列で始まり、セルトリ細胞分化への引き金を引いていると考えられる。ただし、Sryの発現が一過性であるのに対して、DMYの発現は親の精巣でも検出できる。性ホルモン処理により性転換したDMYを持たないXX雄が正常な精巣を持っていることを考えると、親精巣でのDMYの発現は機能的に意味がないのかも知れない。
また、DMY遺伝子上流の発現制御領域にGFPにつないだコンストラクトを導入したトランスジェニックメダカのGFPシグナルは、精巣の体細胞で検出できるだけでなく、卵巣の生殖細胞周辺の体細胞でも検出できる。このことから、DMYの発現制御領域には、生殖細胞周辺の体細胞で発現するというポテンシャルがあると解釈している。XX個体の生殖巣とXY個体の生殖巣との両方に、DMYが発現可能な「場」は同等に存在しているが、XY個体のみがDMYをもつため、DMYが発現・機能し、生殖巣を精巣方向へと導いていくのだと考えている(松田ら未発表)。
3. DMYの機能と生殖細胞数
XYでありながら機能しないDMYをもつ突然変異体は雌に分化する17)。一方、エストロゲン処理でもXY雌を誘導することが可能である。しかし、この両者について、稚魚期の生殖細胞数変化を比較すると、違いが認められる。DMY突然変異体の生殖細胞数は基本的に雌と同じパターンで変化し、孵化前に増加し、孵化後は減数分裂に移行する。一方、エストロゲン処理したXY個体では、生殖細胞の数は、孵化した時点で正常なXX個体ほど多くなく、正常なXY個体の数に近い。しかし、正常なXX個体と同様に減数分裂の指標となるScp3を発現する生殖細胞が観察できる18)。孵化後は正常XY個体と比較して生殖細胞数が顕著に増加し、XXと同様な生殖巣の形態になる。
一方、DMYのゲノム領域を導入したXXメダカや、DMYをXX胚に強制発現させた場合には、初期からXY胚と同様の生殖巣性分化パターンを示す個体が現れる12)。これらの結果は、DMYが生殖細胞の分裂制御に密接に関わっていることを暗示している。
●メダカの性の可塑性と性決定遺伝子の進化・多様性
野生集団から発見したDMY突然変異体の多くは正常な(野生型)DMYの1塩基のin/delだった。機能欠損型DMYをもつY染色体を仮にY*とすると、このY*染色体は機能的にはX染色体と等価である。交配により作出したY*Y*は雌に、Y*Yは雄に分化する17)。つまり、この変異系統では、Y*染色体とY染色体との違いは1塩基であるということになる。現存する多くの種のうちには、「X染色体とY染色体との違いは1塩基」であるということがあり得ると思われる。このような染色体構成の種では、性決定遺伝子同定は極めて難しくなるだろう。Y染色体上にX染色体には存在しない250kbもの挿入配列のあったメダカは幸運だったのかもしれない。メダカの性は性ホルモン投与や受精卵の高温処理19)などによって容易に変更可能である。その理由は、雌雄の遺伝的な違いが極めて小さいことによるとも言えるのである。
●今後の課題
メダカの性決定遺伝子が明らかとなったことで、脊椎動物における性決定遺伝子の多様性の実体が明らかとなってきた。その一方、精巣形成や卵巣形成など生殖巣の性分化課程は脊椎動物の間で保存性が高いことから、脊椎動物に共通したメカニズムがあるとも推定できる。今後、DMY自体の機能と精巣分化の遺伝子カスケードをつなげることが重要な課題である。
一方、メダカに近縁な種に関しては、性決定遺伝子同定計画が進行しており、近い将来、それぞれの種の性決定遺伝子が次々に明らかとなることが期待できる。生殖巣性分化の遺伝子カスケードが保存されているとすれば、カスケードの様々な段階の遺伝子は、それぞれの種で性決定遺伝子として働き得る。新たに発見される近縁種の性決定遺伝子やメダカ種内に存在するDMY以外の性変更遺伝子変異20) などを同定・解析することによって、脊椎動物の性分化の遺伝子カスケードが浮かび上がってくることを期待している。
●謝辞
本研究の遂行のためには、多くの方々の協力が必須でした。特に基礎生物学研究所の長濱 嘉孝教授には物心両面でサポートして頂きました。基生研の電子計算機室、分析室からの支援も頂きました。また、辛口で有意義な議論をしていただいた濱口 哲教授を始めとする新潟大学の研究室の皆様の貢献はたいへん大きなものでした。この場を借りて心より感謝いたします。
●文献
1) Matsuda, M., Nagahama, Y., Shinomiya, A., Sato, T., Matsuda, C., Kobayashi, T., Morrey, C. E., Shibata, N., Asakawa, S., Shimizu, N., Hori, H., Hamaguchi, S. and Sakaizumi, M. DMY is a Y-specific DM-domain gene required for male development in the medaka fish. Nature, 417: 559-563 (2002).
2) Kasahara, M., Naruse, K., Sasaki, S., Nakatani, Y.,他. The medaka draft genome and insights into vertebrate genome evolution. Nature, 447: 714-719 (2007).
3) Matsuda, M., Yonekawa, H., Hamaguchi, S. Sakaizumi, M. Geographic variation and diversity in the mitochondrial DNA of the medaka, Oryzias latipes, as determined by restriction endonuclease analysis. Zool. Sci., 14: 517-526 (1997).
4) Matsuda M., Matsuda C., Hamaguchi S., Sakaizumi M. Identification of the sex chromosomes of the medaka, Oryzias latipes, by fluorescence in situ hybridization.
Cytogenet. Cell Genet., 82: 257-263 (1998).
5) 四宮愛、濱口哲、酒泉満. メダカの性決定遺伝子と生殖巣の性分化 脊椎動物の新しい性決定遺伝子DMY. 細胞工学 22: 1090-1096 (2003).
6) 長濱嘉孝、松田勝. メダカの性決定遺伝子. 細胞工学 25: 364-368 (2006).
7) Matsuda M., Kawato N., Asakawa S., Shimizu N., Nagahama Y., Hamaguchi S., Sakaizumi M., Hori H. Construction of a BAC library derived from the inbred Hd-rR strain of the teleost fish, Oryzias latipes. Genes Genet. Syst., 76: 61-63 (2001).
8) Matsuda M., Sotoyama S., Hamaguchi S., Sakaizumi M. Male-specific restriction of recombination frequency in the sex chromosomes of the medaka, Oryzias latipes. Genet. Res. Cambr., 73: 225-231 (1999).
9) Sato T. Yokomizo S., Matsuda M., Hamaguchi S. and Sakaizumi M. Gene-Centromere Mapping of Medaka Sex Chromosome using Triploid Hybrids between Oryzias latipes and O. luzonensis. Genetica, 111, No. 1-3: 71-75 (2001)
10) Matsuda, M., Kusama, T., Kurihara, Y., Oshiro, T., Hamaguchi, S. Sakaizumi, M. Isolation of a sex chromosome-specific DNA sequence in the medaka, Oryzias latipes. Genes Genet. Syst., 72: 263-268 (1997).
11) Shinomiya, A, Otake, H., Togashi, K., Hamaguchi, S., Sakaizumi, M. Field survey of sex-reversals in the medaka, Oryzias latipes: genotypic sexing of wild populations. Zool. Sci., 21: 613-619 (2004).
12) Matsuda, M., Shinomiya, A., Kinoshita, M., Suzuki, A., Kobayashi, T., Paul-Prasanth, B., Lau, E-l., Hamaguchi, S., Sakaizumi, M. and Nagahama, Y. DMY induces male development in XX medaka fish. Proc Natl Acad Sci. 104: 3865-3870 (2007).
13) Matsuda, M., Sato, T., Toyazaki, Y., Nagahama, Y., Hamaguchi, S. and Sakaizumi, M. Oryzias curvinotus Has DMY, a Gene That Is Required for Male Development in the Medaka, O. latipes. Zool. Sci., 20: 159-161 (2003).
14) Takehana, Y., Demiyah, D., Naruse, K., Hamaguchi, S. and Sakaizumi, M. Evolution of different Y chromosomes in two medaka species, Oryzias dancena and O. latipes. Genetics 175: 1-6 (2007).
15) Takehana, D., Naruse, K., Hamaguchi, S., Sakaizumi, M. Evolution of ZZ/ZW and XX/XY sex-determination systems in the closely related medaka species, Oryzias hubbsi and O. dancena. Chromosoma, in press.
16) Kobayashi, T., Matsuda, M., Kajiura-Kobayashi, H., Suzuki, A., Saito, N., Nakamoto, M., Shibata, N. and Nagahama, Y. Two DM domain genes, DMY and DMRT1, involved in testicular differentiation and development in the medaka, Oryzias latipes. Dev. Dyn., 231: 518-526 (2004).
17) Otake, H., Shinomiya, A., Matsuda, M., Hamaguchi, S., Sakaizumi, M. Wild-derived XY sex-reversal mutants in the medaka, Oryzias latipes. Genetics, 173: 2083-2090 (2006).
18) Paul-Preasanth, B., Matsuda, M., Lau, E-L., Suzuki, A., Sakai, F., Kobayashi, T. and Nagahama, Y. Knock-down of DMY initiates female pathway in the genetic male medaka, Oryzias latipes. Biochem. Biophys. Res. Commun., 351: 815-819 (2006).
19) Sato, T., Endo, T., Yamahira, K., Hamaguchi, S., Sakaizumi, M. Induction of female-to-male sex reversal by high temperature treatment in Medaka, Oryzias latipes. Zool. Sci., 22: 985-988 (2005).
20) Shinomiya, A., Kato M., Yaezawa, M., Sakaizumi, M., Hamaguchi, S. Interspecific hybridization between Oryzias latipes and Oryzias curvinotus causes XY sex reversal. J. Exp. Zool., 305A: 890-896 (2006).
|