
図1(クリックして拡大)
はじめに
ショウジョウバエ遺伝学の開祖であるトーマス・ハント・モーガンは、ショウジョウバエを使う前は精力的にプラナリラアの再生研究をやっていた。実は、彼の1900年の論文にプラナリアのエサとしてショウジョウバエが登場する。これが彼のショウジョウバエに関する最初の記述である。しかし、時代はプラナリアのエサであったショウジョウバエが遺伝学の、そして発生学の主流へとのし上がっていったのである。姫工大の渡辺憲二氏とプラナリアの地位奪還にむけてプラナリアの研究を開始したのは1991年のことである。
しかし、プラナリアを使い始めてわかったことは、分子・細胞生物学的アプローチをするには極めて扱いにくい生き物であることであった。全身に分布する腸・大量に分泌される粘液。細胞を解離するときにプロテアーゼ・インヒビターを使うという逆転の発想をせざるをえなかったのは象徴的な出来事であった。粘液はwhole mount in situ hybridizationをするときの高い障壁となり、塩酸処理・カルノア固定・ヘパリン処理といった独特のプロトコールを作るのに3年の歳月を要することになった。
けれども、問題点を克服した先には、多くの楽しみと驚きがあり、サイエンスをしていることの喜びを堪能させてくれた。ここでは、何を観察し、何を考え、何を証明したのかを中心にプラナリアの研究を紹介したい。
再生芽は何をしているの?
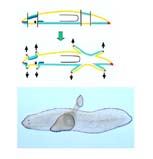
プラナリアの再生を観察していて最初に疑問に思ったことは、再生芽というものである。プラナリアの再生を細胞レベルで観察することにこだわり、whole mount in situ hybridizationも発色液BCIP/NBTの組成を工夫して遺伝子の発現を細胞単位で追跡できるようにした。その結果、どう贔屓目に見ても再生芽で再生の細胞イベントが起きているとは思えないのである。再生芽というのは、<再生のメインイベントが起きている場所>という先入観を捨てなくてはならなくなった。といって、再生芽は、歴然として再生芽として孤高の構造をとっており、やはり何か重要な機能があることを否定することはできなかった。ある日、再生芽は<再生のイベント引き起こすセンター>という仮定を与えて再生を考え直してみた。すると目からウロコが落ちるように全てが解釈できたのである。図1を見てもらいたい。切り口の前側にできる再生芽は頭部、後ろ側にできる再生芽は尾部として、残りの断片との間でインターカレーション(領域の再編成)を起せば、どの断片も必ず1個体に再生できることが簡単に説明できるのである。そう、再生芽をインターカレーション(領域の再編成)を引き起こすためのセンターという役割を与えれば、孤高の構造をとっていることに対してもプライドを傷つけることなく説明できることに気が付いたのである1-4。
この仮説を証明するために、再生芽の移植実験を考えたが、再生芽の移植はデリケートすぎて、小林千余子という器用な院生をもってしても実現不可能であった。そこで、われわれは前後軸をずらした移植実験によってインタカーレーションが引き起こされるかどうかを調べてみた。昔の移植実験で異所的な咽頭が形成されていることがすでに観察されていたので、高い勝算をもって実験を進めた。マーカーで染めてみると咽頭のみならず、脳も首部分も全部が異所的に形成されていることが証明できたのである5。この移植実験ではHox遺伝子の発現も再編成されることから、領域の再編成が起きていることの分子的な根拠も与えられた5,6。

再生芽の形成を引き起こすものは?
再生芽は再生の場ではないものの、再生の鍵を握る存在であることには間違いない。では、そのプラナリアの再生の鍵を握る再生芽の形成は何が引き起こすのだろうか。昔からいくつかの仮説が提唱されていた。①神経が切断され、神経繊維の切り口から再生芽の形成を引き起こす因子が放出される。②切断された腸から放出されるプロテアーゼが再生芽形成を引き起こす。③切断による炎症反応が再生芽形成の引き金となる。しかし、意外な展開から新しい仮説がつくられた。当時姫工大の院生だった加藤健太郎は、背腹軸の逆転移植を行って詳細な細胞イベントを観察していた。背腹軸の逆転移植によってラッパ状の突起が形成されることが古くから観察されていたが、細胞マーカーを使って観察すると、逆転移植をした境界に新たな背と腹の境界の細胞が形成されており、背と腹が接した点を突起の頂点として、再生芽様の構造を形成し、その再生芽様の突起の内に新たな背腹軸を形成していることを見出したのである(図2)7,8。すなわち、前後軸と同じく、背腹軸についてもインターカーレーションが起きていることが判明したのである。この結果を考察しているときに、背と腹が異所的に接したところに再生芽様のものができるとなると、ひょっとすると切断したときに傷口が巾着を閉じるようにふさがると異所的に背と腹が接することになり、これが再生芽形成の引き金となっているのではないかと考えはじめた。しかし、傷口か閉じたときに本当に背と腹の細胞が接するかを証明することは難しかった。ところが、遺伝研の五條堀研とのESTプロジェクトでプラナリアのnoggin 様の遺伝子(Djnlg)がとれ、先ほどの背腹軸の逆転移植実験をすると背と腹の接した境界にDjnlg 遺伝子の発現が誘導されることがわかったのである。そして、驚くべきことに、プラナリアを切ると普段は発現していないDjnlg 遺伝子が傷口の塞がったところに発現誘導されることがわかり、傷口が閉じたときに背と腹の組織が接して、Djnlg 遺伝子の発現が誘導され、再生芽が形成されることを示唆する結果となった9,10。
再生に参加する細胞は?
以上のように、プラナリアがどこで切っても再生できる基本原理の理解が進んだが、再生に参加する細胞についての理解はなかなか進展しなかった。全能性の幹細胞(通称、新生細胞)がプラナリアでは全身に分布しており、それが再生に必要な細胞を供給するからだと言われているものの、その実験根拠は実に甘いものであった。スペインのグループが密度勾配遠心で小型の細胞を集めて、X線照射して幹細胞をなくしたプラナリアに移植して再生能をレスキューさせるのに成功したという論文が1987年のDevelopmentに載っていたが、これをもって全能性幹細胞の存在を示したとするにはあまりにも貧弱な実験であった。細胞は密度で分けただけのいろいろな種類の細胞の混在したものだし、ドナー細胞の識別も核型でしたと書いてあるだけのもので、やはり、細胞培養に成功するかsingle cellの移植実験に成功しない限り、プラナリアが広く認められる存在にならないと思われた。
細胞培養システムの構築には毎年チャレンジし続けているが、今だに成功していない。幹細胞のマーカーについても、細胞内構造物・受容体に着目して、DjvlgA, DjFGFR1/2 という幹細胞のマーカー候補遺伝子を同定したものの11-13、その発現細胞が本当に幹細胞ということを証明するためには、発現細胞を細胞培養して増殖能と多分化能を示すか、マーカーつきで移植して全能性を示すしかないのだから極めて困難な状況が続いている。
しかし、最近になってセルソーターを使って新たな展開が得られつつある。まず、細胞培養の最大の障壁だった腸の細胞(プロテアーゼを分泌して他の細胞を殺してしまう)を完全に除去できたばかりか、X線を照射したプラナリアの解離細胞と比較することによって、増殖中の細胞や幹細胞の細胞分画を集めることができるようになったのである(未発表)。また、この幹細胞分画の精製によって幹細胞に特異的な遺伝子群のクローニングに成功し、飛躍的な研究の進展が見られ始めた。さらに、セルソーターのすごいところは、1個1個の細胞を確実に集められる点にあり、現在では幹細胞1個1個の細胞ついて遺伝子プロファイリングができるようになり、今までみえなかった幹細胞の不均一性が明らかになりつつある。
再生を制御する遺伝子は?
先に述べたようにプラナリアの幹細胞は、体の領域性をつくる遺伝子システムによって制御されているらしい。共同研究者の一人である遺伝研の五條堀研の中澤真澄は、プラナリアのDNA chipを作ってプラナリア頭部で特異的に発現する遺伝子を200個近く同定しており、その中で頭部に領域特異的に発現する遺伝子が2個同定されていた。岡山大学に在籍している時に、それらの遺伝子を小林千余子がRNAi法でノックアウトし、Francesc Cebria(通称Kiku)がノックアウト・プラナリアの表現型を解析していった。そのうちのひとつ#721遺伝子は頭部領域に極めて特異的に発現しており、ノックアウトしたプラナリアでは頭部が形成されないことが期待された。しかし、結果は全く我々の期待とは違い、脳も眼も普通に再生してしまい失望する結果となった。ところが、しばらくするとRNAiを施した105匹のプラナリアの内、101個体に眼玉が異所的に形成されるのが観察された。Kikuがそれらのプラナリアの脳を染色すると、Kikuが驚いた表情で我々に結果を見せた。何と、体中に脳が異所的にできているではないか!!??。これには、みんな驚いた。全身、脳だらけのプラナリアができてしまったのである。確かにプラナリアではどこからでも脳が再生できるのだから、体中に脳になりうる細胞があるはずなので、そんなに驚くべきことではないのだが----。これだけ視覚的にクリアに見せられると改めてプラナリアの凄さを感じずにはいられなかった。この発見は、体中に分布している全能性の幹細胞が頭部でだけ脳の神経細胞に分化するように制御している遺伝子システムが存在することを明らかにするとともに、我々はその遺伝子の一つを同定することに成功したことを意味している。しかし、<頭部で特異的に発現>していながら、ノックアウトすると<その影響は体幹部にでる>というユニークな表現型であったために、この遺伝子機能の謎解きには多くの実験が必要になった。最終的には、東大の平良氏にゼノパス胚にこの遺伝子をうってもらって生化学的な解析を加えて、プラナリアの研究で初めて雑誌Natureに載ることが決まったのである14。
プラナリアの脳
プラナリアの脳は単純だから簡単に再生できるのだと誰もが思っていたが、調べれば調べるほどプラナリアの脳は我々の予想以上に良く組織化されていることがわかってきた15-17。私自身は、プラナリアの脳の再生過程を追跡できる神経マーカーがあればよいと思っていたが、脳再生に関与する遺伝子の同定に執念を燃やしたのは当時神戸大学の院生だった梅園良彦である。彼は、プラナリアから苦労の末、3種類のotd/Otx ホメオボックス遺伝子群をクローニングし、発現量の少ないotd/Otx ホメオボックス遺伝子群の発現を根性で染め出し、当時としては画期的な成果を出したのである18,19。何と、プラナリアでもotd/Otx ホメオボックス遺伝子群は脳の領域構造に応じた発現パターンをしていたのである。その後ESTプロジェクトやDNA chipプロジェクトで次々と神経マーカーが同定され、プラナリアの脳が実に複雑な機能的・構造的な領域と遺伝子発現パターンによって成立していることが判明したのである20,21。また、梅園が同定したプラナリアの新規神経転写遺伝子から、マウスのホモログ遺伝子が同定され、それがヒトの遺伝病の解明につながるという思わぬ展開もあり、<たかだかプラナリア、されどプラナリア>ということになったのである22。
プラナリアからみた脳の進化
プラナリアの中枢神経系の構造が、脊椎動物の神経胚期に一過的に観察される一次神経系に類似することを見出し(図3)15、従来のガスタングの幼生の神経環から神経管が発達し、それが脳へと進化した説とは異なる新しい説を提唱した。すなわち、中枢神経の基本的なパターンは中枢神経系を獲得したときから成立しており、外胚葉から神経細胞が個々の細胞単位で発生したのか、シート状にまとめて神経細胞に発生したのかの違いで神経管が、そして脳が進化したのではないかと考えた。さらに、プラナリアの神経系およびそこで発現している遺伝子を観察していると、神経系の進化とは遺伝子の進化というより、神経細胞の種類の多様化の方が顕著であることに気が付く。外界の刺激を受け、それを統合して判断するのに必要な遺伝子群はプラナリアにもあり、違うのは情報処理に関与する神経細胞の数と種類である。そういう観点で脊椎動物の神経幹細胞システムを見てみると実におもしろいことに気が付く。もともとプラナリアでは一種類の神経細胞がしていた機能を進化の過程で民営分割化して、多様な細胞に機能分配し一つの神経細胞としてはより専業化することによって情報処理量をあげたのではないかという考え方である。そのように考えると神経幹細胞から多種類の神経細胞・グリア細胞が作られることも良く理解できる。今後、進化というものを<細胞システムの進化>として捉える観点で、その実験的根拠を与えていくことをしたいと思っている。

おわりに
サイエンスが<現象を良く観察する><観察からするどい仮説を導く><仮説を精度の高い実験で証明する>という三段階で成り立つことを、京大の岡田節人研究室にいたときに痛いほど教え込まれた。岡田節人・江口吾朗・竹市雅俊・安田國男・近藤寿人といった錚々たる教官に鍛えられ、安部真一・浜田義雄・漆原秀子・青山裕彦・渥美忠男といった曲者先輩達にたしなめられ、観察を基本にしたサイエンスの手法を身につけた。1979年に大学院に進学したとき、最初にしたことは制限酵素の精製だった。これからの発生学は分子生物学なしには進められないとする岡田節人の先見の明に従い、志村令郎のところに出向して制限酵素を精製し、安田・近藤について分子生物学のABCを習った。プロトコールのないときから分子生物学を始めたことが、プラナリアという扱い難い動物にめげることなく付き合えた最大の要因と思われる。プラナリア研究の基礎は、姫工大時代の渡辺憲二・織井秀文との二人とともに築いたものであり、学会賞の対象となった研究は多くの学生・共同研究者との研究の賜物であり、それらを含めた受賞と思っている。また、いろいろな点でお世話になった、京都大学の宮田隆・岡山大学の倉谷滋・基生研の上野直人の三氏に謝辞を述べて結びとしたい(本文中の敬称略)。